����Ɖu�Ɣ��ʌ��f
����Ɖu�Ɣ��ʌ��f�@Cancer Immunity and Trace Elements
�͂��߂�
�g���Ɖu�h�̗̈�͍זE�����w�A�Ɖu�w�Ȃǂ̑S�Ă��܂���L�͂Ȑ����Ȋw���̂��̂ł���A����ɂ��������ʌ��f�̗̈���܂������ɍL�͂ł���B���������āA���̂悤�ȍL�̈�̊��Ɖu�ɑ�����ʌ��f�̖������p�ɂ��Ę_����ꍇ�������Ƃ��̌����Ώۂ͐����w�S�ʂ��܂ނ��ƂɂȂ�A�^����ꂽ���ʓ��őS�ĂɌ��y���邱�Ƃ͓���B�{�e�ł͂��́g���Ɖu�h��������芪���Ɖu���Ƃ��Ĕ����A���i�W�A�����̂R�̍L�̈�ő����A���ꂼ��̗̈�ɂ�������ʌ��f�̂������������݂܂łɓ����Ă���m�������Ƃɂ܂Ƃ߂Ă݂��B�g���Ɖu�h�ɂ�������ʌ��f�̂��������ɂ͐}�P�Ɏ����悤�ɐ������̋ǖʂ�����[1,2]�B
�g���Ɖu�h�̗̈�͍זE�����w�A�Ɖu�w�Ȃǂ̑S�Ă��܂���L�͂Ȑ����Ȋw���̂��̂ł���A����ɂ��������ʌ��f�̗̈���܂������ɍL�͂ł���B���������āA���̂悤�ȍL�̈�̊��Ɖu�ɑ�����ʌ��f�̖������p�ɂ��Ę_����ꍇ�������Ƃ��̌����Ώۂ͐����w�S�ʂ��܂ނ��ƂɂȂ�A�^����ꂽ���ʓ��őS�ĂɌ��y���邱�Ƃ͓���B�{�e�ł͂��́g���Ɖu�h��������芪���Ɖu���Ƃ��Ĕ����A���i�W�A�����̂R�̍L�̈�ő����A���ꂼ��̗̈�ɂ�������ʌ��f�̂������������݂܂łɓ����Ă���m�������Ƃɂ܂Ƃ߂Ă݂��B�g���Ɖu�h�ɂ�������ʌ��f�̂��������ɂ͐}�P�Ɏ����悤�ɐ������̋ǖʂ�����[1,2]�B
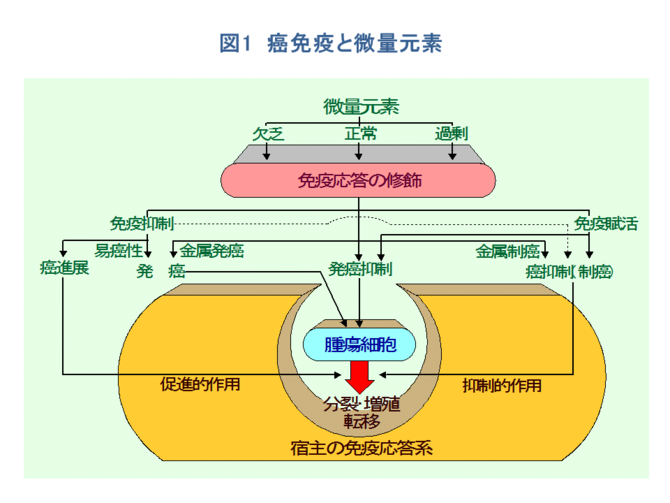
�P�D�����Ɣ��ʌ��f
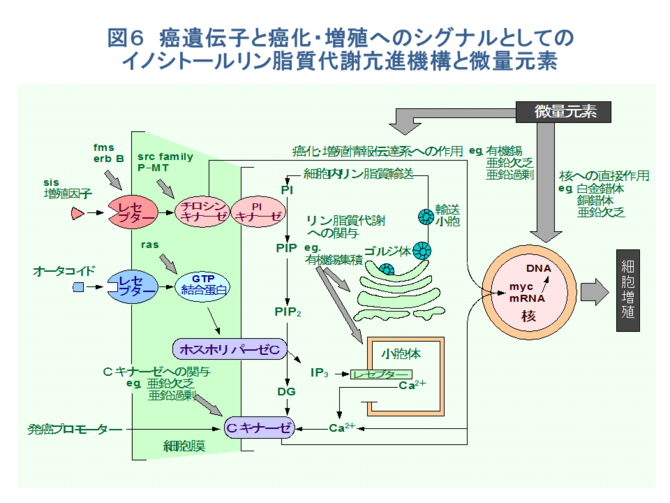
�@�����̈�ɂ�������ʌ��f�̂��������ɂ͑�ʂ��ĂQ����B�P�͔��ʌ��f�̌��R���邢�͉ߏ�ɂ��̓����ʌ��f�̃z���I�X�^�V�X������A��ʍזE����Ӕ\��y�f�A�z�������A�T�C�g�J�C���Ȃǂ̊������\���}�����邢�͘��i����i�����������ߋ@�\�̗���j�A�Ɖu�����Ɉُ�E�������i�Ɖu�����̗���j�A�Պ����ƂȂ�ꍇ�ł���[1-10]�A���̂P�͂������������������i������Ԃ̂��ƂŁA�����������i���������ʌ��f�Ȃǁj�i�\�P�j�ɂ���X��DNA��Q���������A���̂�����̂��זE���B�╪���ɂ�������`�q�@�\��j�邢�͕ω������A�����ւƌ��т��ꍇ�ł���i�}�Q�j�B
�@�Ƃ��ɁA���ʌ��f�ɂ��������זE�����̋ǖʂ���l�@����ƁAG�P���ɂ���זE��DNA������̔��ʌ��f�ɂ���đ��������ꍇ�A�P�jG�P�T�C�N�����₻�̃p�[�g�i�[�Ȃǂ�G�P������q���ψق��邩�A�������͂��̑��B�}���V�O�i���̓`�B��Q���N����A���B�����s�����ꍇ��A�Q�j�זE�����̒������Ď�����זE�����Ď��V�X�e���icheckpoint control�j[11]���r�����A��`�q����F�̂ɕψق�~�ς�������ꍇ�Ȃǂ��N����A➀�ُ푝�B�A➁��`�I�s���萫�i��`�q�̓ˑR�ψٕp�x�������|����`�q����}����`�q�̕ψق����p�x�A���F�̂̌����A�]���A�����Ȃǁj�A➂�Z���i�]�ڂ̌����j�ȂǁA�����������Â����Ă������̂ƍl������i�}�R�j�B
�@�ȏ�̂悤�Ȕ����@�\�̒��ŁA�Ƃ��ɋ����ɂ�锭�����g�^�̔������h�ɂ����̂�����Ƃ��P�Ȃ�ٕ��h���ichronic irritation theory�j���邢�͖Ɖu�\�̒ቺ�ɂ��g���������̔������h�ɂ����̂��m�Ɏ��ʂ��邱�Ƃ͌��݂̂Ƃ������A�q�g�̏ꍇ�A�u�w�I�����ɂ�锻�肪�t�������B���݁C�q�g�ɂ����ĉu�w�I�ɔ��������ؖ�����Ă�����̂̓N�����C�j�b�P���C�q�f�ł���C�u�w�I�ؖ����s�\���Ȃ��̂̓x�����E���C�J�h�~�E���ł���B�S�C�����C�Z�����C���Ȃǂ̓q�g�ł̏ؖ��͂Ȃ��C���������I�ɂ��̔�����������Ă͂�����̂́h���������̔������h�̈���o�Ȃ�(�\�P)�B
�@�����̈�ɂ�������ʌ��f�̂��������ɂ͑�ʂ��ĂQ����B�P�͔��ʌ��f�̌��R���邢�͉ߏ�ɂ��̓����ʌ��f�̃z���I�X�^�V�X������A��ʍזE����Ӕ\��y�f�A�z�������A�T�C�g�J�C���Ȃǂ̊������\���}�����邢�͘��i����i�����������ߋ@�\�̗���j�A�Ɖu�����Ɉُ�E�������i�Ɖu�����̗���j�A�Պ����ƂȂ�ꍇ�ł���[1-10]�A���̂P�͂������������������i������Ԃ̂��ƂŁA�����������i���������ʌ��f�Ȃǁj�i�\�P�j�ɂ���X��DNA��Q���������A���̂�����̂��זE���B�╪���ɂ�������`�q�@�\��j�邢�͕ω������A�����ւƌ��т��ꍇ�ł���i�}�Q�j�B
�@�Ƃ��ɁA���ʌ��f�ɂ��������זE�����̋ǖʂ���l�@����ƁAG�P���ɂ���זE��DNA������̔��ʌ��f�ɂ���đ��������ꍇ�A�P�jG�P�T�C�N�����₻�̃p�[�g�i�[�Ȃǂ�G�P������q���ψق��邩�A�������͂��̑��B�}���V�O�i���̓`�B��Q���N����A���B�����s�����ꍇ��A�Q�j�זE�����̒������Ď�����זE�����Ď��V�X�e���icheckpoint control�j[11]���r�����A��`�q����F�̂ɕψق�~�ς�������ꍇ�Ȃǂ��N����A➀�ُ푝�B�A➁��`�I�s���萫�i��`�q�̓ˑR�ψٕp�x�������|����`�q����}����`�q�̕ψق����p�x�A���F�̂̌����A�]���A�����Ȃǁj�A➂�Z���i�]�ڂ̌����j�ȂǁA�����������Â����Ă������̂ƍl������i�}�R�j�B
�@�ȏ�̂悤�Ȕ����@�\�̒��ŁA�Ƃ��ɋ����ɂ�锭�����g�^�̔������h�ɂ����̂�����Ƃ��P�Ȃ�ٕ��h���ichronic irritation theory�j���邢�͖Ɖu�\�̒ቺ�ɂ��g���������̔������h�ɂ����̂��m�Ɏ��ʂ��邱�Ƃ͌��݂̂Ƃ������A�q�g�̏ꍇ�A�u�w�I�����ɂ�锻�肪�t�������B���݁C�q�g�ɂ����ĉu�w�I�ɔ��������ؖ�����Ă�����̂̓N�����C�j�b�P���C�q�f�ł���C�u�w�I�ؖ����s�\���Ȃ��̂̓x�����E���C�J�h�~�E���ł���B�S�C�����C�Z�����C���Ȃǂ̓q�g�ł̏ؖ��͂Ȃ��C���������I�ɂ��̔�����������Ă͂�����̂́h���������̔������h�̈���o�Ȃ�(�\�P)�B
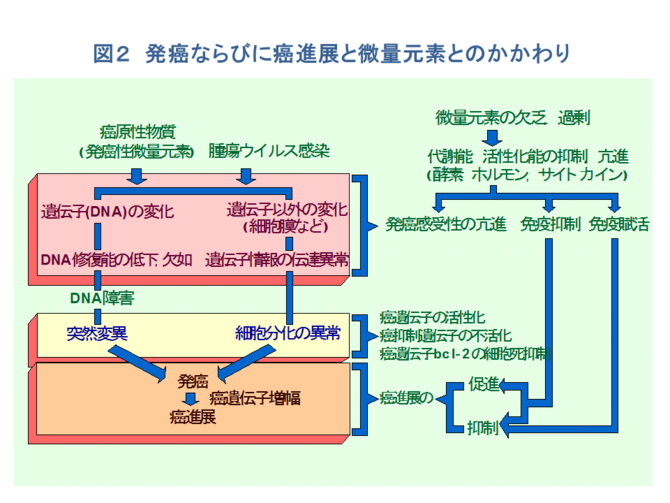
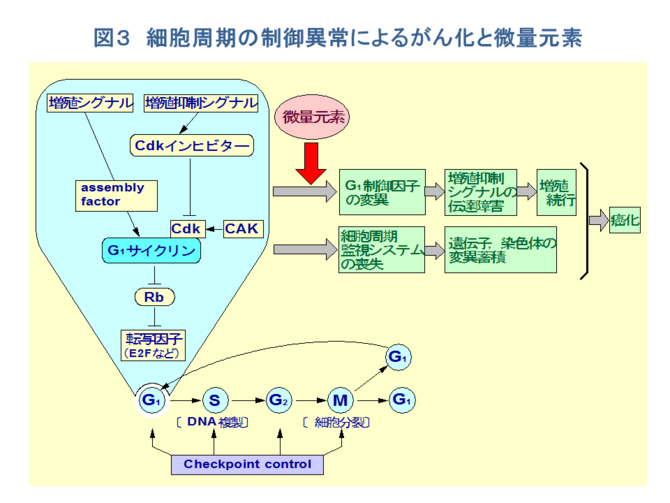
�Q�D���i�W�Ɣ��ʌ��f
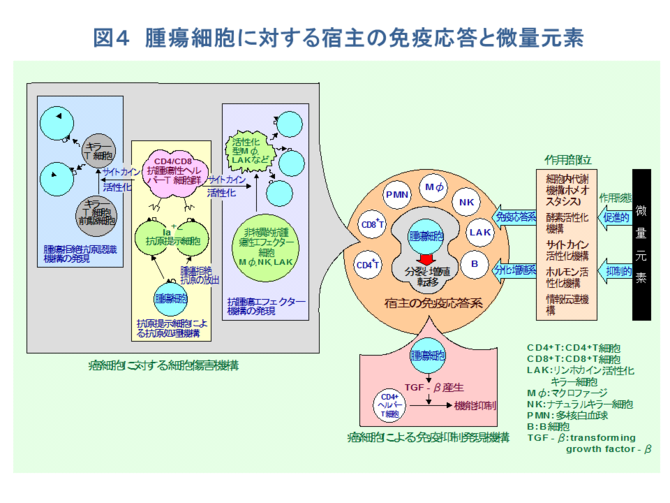
�@���Ɖu�̒��j���Ȃ��̂͊��ɑ���h��̖Ɖu�����ł��邪�A���̎�̂͂P�j���זE�ɑ���זE���Q�@�\�ƂQ�j���זE�ɂ��Ɖu�}�������@�\�ł���B���Ȃ킿�A➀�זE�̊����Ȃ�тɊ��R���̔����@�\�A➁��ᇍזE�̂���ᇋ���R���ɂ��w���p�[T�זE�̊������@�\�i�R���@�\�j�A➂�w���p�[T�זE�R���̃T�C�g�J�C���ɂ�肻�̃N���[���̑��B����������������A��ᇋ���R������ٓI�ɔF�����A�זE���Q�����������L���[T�זE�̎�ᇋ���R���F���@�\�A������➃�w���p�[T�זE�R���̃T�C�g�J�C���ɂ�芈��������A��ᇍזE�R�������ٓI�ɔj�銈�����}�N���t�@�[�W�iM�Ӂj�A�i�`�������L���[�זE�iNK�j�A�����z�J�C���������L���[�iLAK�j�זE�Ȃǂ̃G�t�F�N�^�[�זE�Q���}����R��ᇃG�t�F�N�^�[�@�\�A➄��X�̃G�t�F�N�^�[�זE�̗U���A�����A���B�ɂ������T�C�g�J�C������т��̃J�X�P�[�h�̕��q�쓮�@�\�A➅�h��L���[�זE�ɂ���ᇍזE�j��̐����w�I�A�y�f�w�I�@�\�Ȃǂ���������i�}�S�j�B
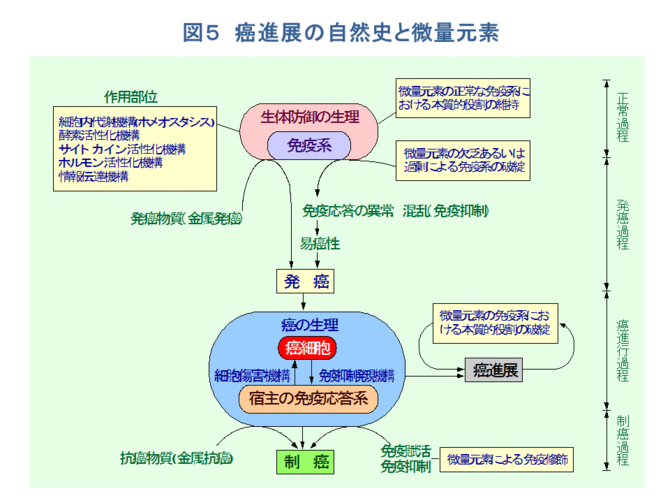
�@������ɁA�����̋@�\�Ɋ֗^����̂͑S�čזE���Ɖu�ł���A�t���Ɖu�͂قƂ�NJ֗^���Ȃ��B���������āA���Ɖu��S���͍̂זE���Q��T�זE����уw���p�[T�זE�܂��̓T�v���b�T�[T�זE�Ƃ������ƂɂȂ�B���̌n�ɑ��āA���ʌ��f�͑��i�I�Ȃ�тɗ}���I�ȗ��ʂ��瓭���B���Ȃ킿�A���ʌ��f�͂��ꂼ�ꂪ�����������Ɉˑ����Ē��ڂɁA���邢�͍זE����ӂ�זE�����֗^�̍y�f�A�T�C�g�J�C���A�z�������Ȃǂ̊������@�\��V�O�i���`�B�@�\�ւ̉e������ĖƉu�������C�����A���זE�̕���A���B�A�]�ڂȂǂ̊��i�W�ɂ�������Ă���[1,2,5-10]�B�܂���������A���i�W�̗̈�ɂ�������ʌ��f�̂��������ɂ͂P�j���i�W�ɔ����ĖƉu�n�ɂ�������ʌ��f�̖{���I�����ɔj�]�𗈂����ꍇ��A�t�ɂQ�j���̔j�]�����i�W�𑣐i������ꍇ�A����ɂR�j���זE���B�ɕK�v�ȓ�����ʌ��f�̗v�����̑���A���邢�͂S�j����ɑ��ė}���I�ɓ������ʌ��f�̑���Ȃǂ̋ǖʂ�����i�}�T�j�B
�@���������āA�g���h�Ƃ�������Ȋ����ł̔��ʌ��f�̓����i�\�Q�j��Ӌ`�i�\�R�j��m�邱�Ƃ͕a�Ԕc���̏ォ����d�v�ł���B���Ȃ킿�A�S�����̂ɂ�������ʌ��f�̗L�ӂ̕ϓ������i�W�̒��ڂ̌����ƂȂ蓾��̂��ۂ��i���邢�͑��i�I�ɓ����̂��ۂ��j�A���邢�͒P�Ȃ錋�ʂł���̂��ۂ��͈����Ȃ�тɃZ�����������Ă͍���̉ۑ�ł��邪�A�Տ���A���̐i�W�x����c������w�W�Ƃ��Ă͋ɂ߂ėL���ł���B
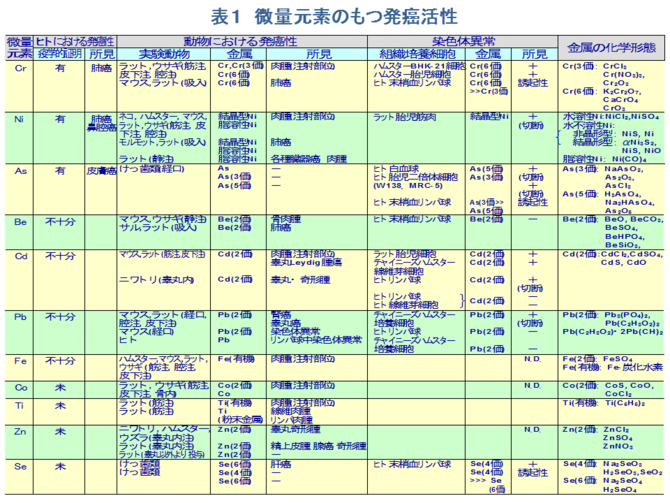
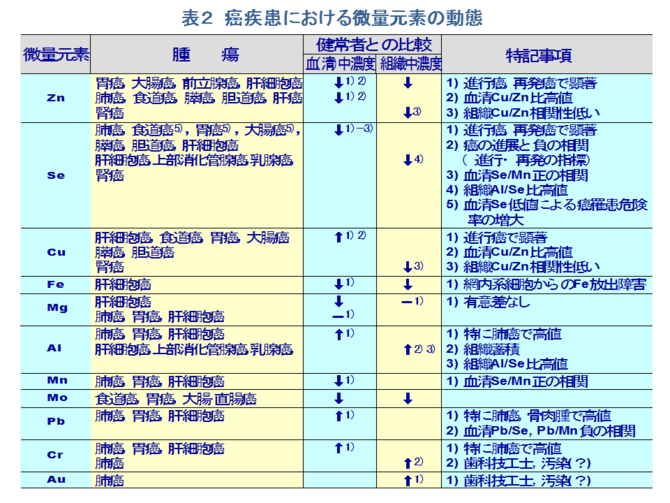
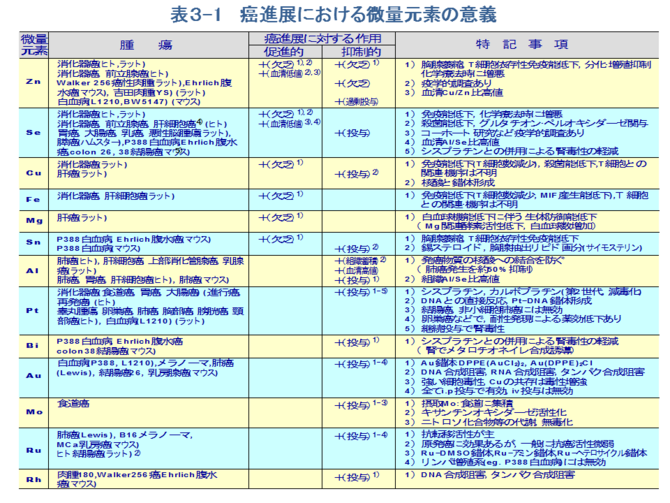
�@���ۂɁA����܂łɂ����Ɖu�ɂ�������ʌ��f�̈Ӌ`���������������ړI�Ŏ�X�̎�ᇕ��ʂɂ�������ʌ��f�������Ă���B�Ƃ��Ɍ��t���̔��ʌ��f�̓��Ԃ͊��̐i�W�x�����ɔ��f���A�i�s���A�Ĕ����Ō����ɕϓ�����B��ʂɈ��������ł͌����Z�����l�Ȃ�тɌ��������l���ቺ���A�������l���㏸���ACu/Zn�䂪���l���������Ƃ����ʂ̏����Ƃ��ĔF�߂���i�\�Q�j[12-20]�B�Z�����͈ȑO��蔭���Ƃ̊֘A�Œ��ڂ���Ă���A�u�w�I�ɂ��Z�����ێ�ʂ��邢�͌����Z�����Z�x�Ɗ��̎��S���Ƃ����̑��ւ���������[21,22]�A�����Z�����Z�x�̒Ⴂ�҂̕������i�Ƃ��ɏ����������ёO���B���j�̔���������������[23]�Ȃǂ�����Ă���B��ʂɌ����Z�����l�͊��̐i�s�ƂƂ��ɒ�l�������A���̐i�s��Ԃ��邢�͉h�{��c�������w�W�ɂȂ�B�܂��C�Z�����͎�ᇍזE�̑��B�ɗ}���I�ɓ����i�\�R�j[24-27]� ���Ȃ킿�A��������Ȃǂ̃R�[�z�[�g�����ɂ���Ċ���Ԃ��������Z������ቺ������̂ł͂Ȃ��A��Z������Ԃ������늳�̊댯�x�������邱�Ƃ��������Ă���[28]�B���������ɂ����Ă��݊�[29]�A�咰��[30]�A����[31]�Ȃǂ��K�ʂ̃Z�����Y���ɂ��}������Ă���B�������A�H���ւ̃Z������[����ᇂ̐�����}������Ƃ�����[32]�����锽�ʁA�t�ɂ��̏ꍇ�ł��g�D���邢�͌����Z�����Z�x�͐H���R���̃Z�����Z�x�f����݂̂ŁA�R��ᇌ��ʂ̎w�W�ɂ͂Ȃ蓾�Ȃ��Ƃ�����[33]������A�Z������[�̕K�v���ɂ��Ă͂���Ȃ錟�������߂���B
�@�������܂����l�ɁA�זE�̕����E���B�ɕK�{�̌��f�ł��邱�Ƃ���A���������̒�l�Ȃ�тɈ������R��Ԃ�������邱�Ƃɂ���ĖƉu�}���ɔ��������Ȃ�тɊ��i�W�̑��i���l���������A�t�Ɏ�ᇑg�D�̎�ᇍזE�̑��B�}���ɔ������i�W�̗}�����l������B�����A�������R�ɂ���ᇑ��B�̗}�����q�g����ѓ����ɂ����ĔF�߂��Ă���[34-39]�i�\�R�j�B���̏ꍇ�A�������R�ɂ��jDNA�ʂ��זE�����iS+G2 M���j�ŗL�ӂ̒ቺ���������Ƃ���A�����̎�ᇑ��B�Ȃ�тɎ�ᇂ̍זE��]�ւ̊֗^���M����[40]�B�܂��A����Ƃ͔��Ɉ����̉ߏ蓊�^����ᇂ̑��B��}������Ƃ���������[41]�B
�@������ɂ���A����҂Ƃ̔�r�ɂ����āA�i�s���A�Ĕ����Ō����ɂ݂��錌�����̈����ቺ�A������Ȃ�тɌ�������/������̍��l�A�܂��������̃Z�����ቺ�A�}���K���ቺ�Ȃ�тɌ������Z����/�}���K����̐����ւȂǂ͋ɂ߂ċ������鏊���ł���B
�@����A��ᇑg�D�ɂ����Ă��u���Əh��̐ڐG�_�v���Ȃ킿��ᇍזE���B�Ǐ��Ƃ��Ĕ��ʌ��f�̓��Ԃ��ł��[�I�ɔ��f����Ă��邱�Ƃ����҂����B�������A���ۂ͎�ᇑg�D���ւ̔��ʌ��f�̎�荞�݂�ܗʂ͎�ᇂ̐i�s�x�A���B��ԁi�������s�������j�A��ᇍזE�̉h�{��ԁA��ᇑg�D���̃T���v���̎�̕��ʂȂǂɂ��傫���قȂ�A�҂ɂ�肻�̒l�̃o���c�L�͑傫���B�Ⴆ�A�����͎�ᇍזE�̕���E���B�ɕK�{�̌��f�ł���A���R��ᇑg�D�ւ̏W�ς��l�����邪�A�����̈����ܗʂ͏]�������Ƃ���Ă����q�g�݊��A�咰���A�̊��A�O���B���Ȃǂɂ����Ă�����g�D�̂�����L�ӂɒ�l�������B�Ƃ��ɁA���x�i�s�A�Ĕ���������ǂł͔��ʌ��f�̒ቺ�X����悷�B����́A����E���B�̐���Ȏ�ᇍזE�͈����̎�荞�݂������ő��ʂ̈������ܗL���邪�A���B�����x�ɐi�s����ƌX�̎�ᇍזE�̉h�{��Ԃ��������A�l�N���[�[��Ԃ̌`���ɂ�ĕ���E���B���s�����ƂȂ�A�����̎�荞�݂��ቺ���邽�߂ł��낤�Ǝv����B���̎�ᇕ��ʂɂ����鈟���̗v�����ƈ����ܗʂƂ̊W�͍���̉ۑ�ł���B���̑��A��ᇕ��ʂɂ����ėL�ӂɕϓ�������ʌ��f�Ƃ��āA�̍זE���A�㕔������B���A���B���Ȃǂ̑g�D�ɂ�����A���~�j�E���̒~�ς∫���]��ᇍזE�ւ̃Z�����̒~�ςȂǂ�����Ă���B
�@���Ɖu�̒��j���Ȃ��̂͊��ɑ���h��̖Ɖu�����ł��邪�A���̎�̂͂P�j���זE�ɑ���זE���Q�@�\�ƂQ�j���זE�ɂ��Ɖu�}�������@�\�ł���B���Ȃ킿�A➀�זE�̊����Ȃ�тɊ��R���̔����@�\�A➁��ᇍזE�̂���ᇋ���R���ɂ��w���p�[T�זE�̊������@�\�i�R���@�\�j�A➂�w���p�[T�זE�R���̃T�C�g�J�C���ɂ�肻�̃N���[���̑��B����������������A��ᇋ���R������ٓI�ɔF�����A�זE���Q�����������L���[T�זE�̎�ᇋ���R���F���@�\�A������➃�w���p�[T�זE�R���̃T�C�g�J�C���ɂ�芈��������A��ᇍזE�R�������ٓI�ɔj�銈�����}�N���t�@�[�W�iM�Ӂj�A�i�`�������L���[�זE�iNK�j�A�����z�J�C���������L���[�iLAK�j�זE�Ȃǂ̃G�t�F�N�^�[�זE�Q���}����R��ᇃG�t�F�N�^�[�@�\�A➄��X�̃G�t�F�N�^�[�זE�̗U���A�����A���B�ɂ������T�C�g�J�C������т��̃J�X�P�[�h�̕��q�쓮�@�\�A➅�h��L���[�זE�ɂ���ᇍזE�j��̐����w�I�A�y�f�w�I�@�\�Ȃǂ���������i�}�S�j�B
�@������ɁA�����̋@�\�Ɋ֗^����̂͑S�čזE���Ɖu�ł���A�t���Ɖu�͂قƂ�NJ֗^���Ȃ��B���������āA���Ɖu��S���͍̂זE���Q��T�זE����уw���p�[T�זE�܂��̓T�v���b�T�[T�זE�Ƃ������ƂɂȂ�B���̌n�ɑ��āA���ʌ��f�͑��i�I�Ȃ�тɗ}���I�ȗ��ʂ��瓭���B���Ȃ킿�A���ʌ��f�͂��ꂼ�ꂪ�����������Ɉˑ����Ē��ڂɁA���邢�͍זE����ӂ�זE�����֗^�̍y�f�A�T�C�g�J�C���A�z�������Ȃǂ̊������@�\��V�O�i���`�B�@�\�ւ̉e������ĖƉu�������C�����A���זE�̕���A���B�A�]�ڂȂǂ̊��i�W�ɂ�������Ă���[1,2,5-10]�B�܂���������A���i�W�̗̈�ɂ�������ʌ��f�̂��������ɂ͂P�j���i�W�ɔ����ĖƉu�n�ɂ�������ʌ��f�̖{���I�����ɔj�]�𗈂����ꍇ��A�t�ɂQ�j���̔j�]�����i�W�𑣐i������ꍇ�A����ɂR�j���זE���B�ɕK�v�ȓ�����ʌ��f�̗v�����̑���A���邢�͂S�j����ɑ��ė}���I�ɓ������ʌ��f�̑���Ȃǂ̋ǖʂ�����i�}�T�j�B
�@���������āA�g���h�Ƃ�������Ȋ����ł̔��ʌ��f�̓����i�\�Q�j��Ӌ`�i�\�R�j��m�邱�Ƃ͕a�Ԕc���̏ォ����d�v�ł���B���Ȃ킿�A�S�����̂ɂ�������ʌ��f�̗L�ӂ̕ϓ������i�W�̒��ڂ̌����ƂȂ蓾��̂��ۂ��i���邢�͑��i�I�ɓ����̂��ۂ��j�A���邢�͒P�Ȃ錋�ʂł���̂��ۂ��͈����Ȃ�тɃZ�����������Ă͍���̉ۑ�ł��邪�A�Տ���A���̐i�W�x����c������w�W�Ƃ��Ă͋ɂ߂ėL���ł���B
�@���ۂɁA����܂łɂ����Ɖu�ɂ�������ʌ��f�̈Ӌ`���������������ړI�Ŏ�X�̎�ᇕ��ʂɂ�������ʌ��f�������Ă���B�Ƃ��Ɍ��t���̔��ʌ��f�̓��Ԃ͊��̐i�W�x�����ɔ��f���A�i�s���A�Ĕ����Ō����ɕϓ�����B��ʂɈ��������ł͌����Z�����l�Ȃ�тɌ��������l���ቺ���A�������l���㏸���ACu/Zn�䂪���l���������Ƃ����ʂ̏����Ƃ��ĔF�߂���i�\�Q�j[12-20]�B�Z�����͈ȑO��蔭���Ƃ̊֘A�Œ��ڂ���Ă���A�u�w�I�ɂ��Z�����ێ�ʂ��邢�͌����Z�����Z�x�Ɗ��̎��S���Ƃ����̑��ւ���������[21,22]�A�����Z�����Z�x�̒Ⴂ�҂̕������i�Ƃ��ɏ����������ёO���B���j�̔���������������[23]�Ȃǂ�����Ă���B��ʂɌ����Z�����l�͊��̐i�s�ƂƂ��ɒ�l�������A���̐i�s��Ԃ��邢�͉h�{��c�������w�W�ɂȂ�B�܂��C�Z�����͎�ᇍזE�̑��B�ɗ}���I�ɓ����i�\�R�j[24-27]� ���Ȃ킿�A��������Ȃǂ̃R�[�z�[�g�����ɂ���Ċ���Ԃ��������Z������ቺ������̂ł͂Ȃ��A��Z������Ԃ������늳�̊댯�x�������邱�Ƃ��������Ă���[28]�B���������ɂ����Ă��݊�[29]�A�咰��[30]�A����[31]�Ȃǂ��K�ʂ̃Z�����Y���ɂ��}������Ă���B�������A�H���ւ̃Z������[����ᇂ̐�����}������Ƃ�����[32]�����锽�ʁA�t�ɂ��̏ꍇ�ł��g�D���邢�͌����Z�����Z�x�͐H���R���̃Z�����Z�x�f����݂̂ŁA�R��ᇌ��ʂ̎w�W�ɂ͂Ȃ蓾�Ȃ��Ƃ�����[33]������A�Z������[�̕K�v���ɂ��Ă͂���Ȃ錟�������߂���B
�@�������܂����l�ɁA�זE�̕����E���B�ɕK�{�̌��f�ł��邱�Ƃ���A���������̒�l�Ȃ�тɈ������R��Ԃ�������邱�Ƃɂ���ĖƉu�}���ɔ��������Ȃ�тɊ��i�W�̑��i���l���������A�t�Ɏ�ᇑg�D�̎�ᇍזE�̑��B�}���ɔ������i�W�̗}�����l������B�����A�������R�ɂ���ᇑ��B�̗}�����q�g����ѓ����ɂ����ĔF�߂��Ă���[34-39]�i�\�R�j�B���̏ꍇ�A�������R�ɂ��jDNA�ʂ��זE�����iS+G2 M���j�ŗL�ӂ̒ቺ���������Ƃ���A�����̎�ᇑ��B�Ȃ�тɎ�ᇂ̍זE��]�ւ̊֗^���M����[40]�B�܂��A����Ƃ͔��Ɉ����̉ߏ蓊�^����ᇂ̑��B��}������Ƃ���������[41]�B
�@������ɂ���A����҂Ƃ̔�r�ɂ����āA�i�s���A�Ĕ����Ō����ɂ݂��錌�����̈����ቺ�A������Ȃ�тɌ�������/������̍��l�A�܂��������̃Z�����ቺ�A�}���K���ቺ�Ȃ�тɌ������Z����/�}���K����̐����ւȂǂ͋ɂ߂ċ������鏊���ł���B
�@����A��ᇑg�D�ɂ����Ă��u���Əh��̐ڐG�_�v���Ȃ킿��ᇍזE���B�Ǐ��Ƃ��Ĕ��ʌ��f�̓��Ԃ��ł��[�I�ɔ��f����Ă��邱�Ƃ����҂����B�������A���ۂ͎�ᇑg�D���ւ̔��ʌ��f�̎�荞�݂�ܗʂ͎�ᇂ̐i�s�x�A���B��ԁi�������s�������j�A��ᇍזE�̉h�{��ԁA��ᇑg�D���̃T���v���̎�̕��ʂȂǂɂ��傫���قȂ�A�҂ɂ�肻�̒l�̃o���c�L�͑傫���B�Ⴆ�A�����͎�ᇍזE�̕���E���B�ɕK�{�̌��f�ł���A���R��ᇑg�D�ւ̏W�ς��l�����邪�A�����̈����ܗʂ͏]�������Ƃ���Ă����q�g�݊��A�咰���A�̊��A�O���B���Ȃǂɂ����Ă�����g�D�̂�����L�ӂɒ�l�������B�Ƃ��ɁA���x�i�s�A�Ĕ���������ǂł͔��ʌ��f�̒ቺ�X����悷�B����́A����E���B�̐���Ȏ�ᇍזE�͈����̎�荞�݂������ő��ʂ̈������ܗL���邪�A���B�����x�ɐi�s����ƌX�̎�ᇍזE�̉h�{��Ԃ��������A�l�N���[�[��Ԃ̌`���ɂ�ĕ���E���B���s�����ƂȂ�A�����̎�荞�݂��ቺ���邽�߂ł��낤�Ǝv����B���̎�ᇕ��ʂɂ����鈟���̗v�����ƈ����ܗʂƂ̊W�͍���̉ۑ�ł���B���̑��A��ᇕ��ʂɂ����ėL�ӂɕϓ�������ʌ��f�Ƃ��āA�̍זE���A�㕔������B���A���B���Ȃǂ̑g�D�ɂ�����A���~�j�E���̒~�ς∫���]��ᇍזE�ւ̃Z�����̒~�ςȂǂ�����Ă���B
�R�D�����Ɣ��ʌ��f
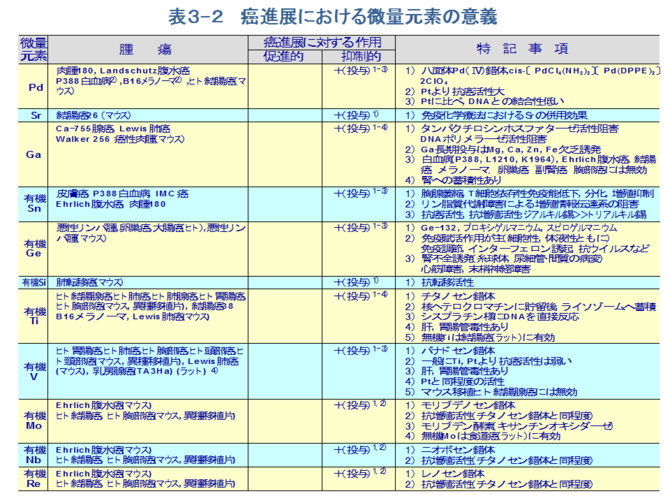
�@���̐i�W�ɑ��Ĕ��ʌ��f���}���I�ɓ����̂́A���݂܂ł̒m���ł́A�����ʂł̈������R�ɂ�鑝�B�}��[42]��A���~�j�E���̑g�D�~�ςɂ�鑝�B�}��[43]�Ȃǂ̑��͂قƂ�ǂ������܂Ƃ��đ̊O��蓊�^���ꂽ�ꍇ�ł���i�\�R�j�B���̐����@���ɂ͂P�j�������̂⓺���̂̔@��DNA�Ƃ̒��ڍ�p�ɂ��ꍇ�A�Q�j�L�@�X�Y�∟���̔@�����B���`�B�n�̑j�Q�i�}�U�A�L�@�X�Y�̓S���W�́A���E�̂ɏW�ς��API��Ӊ�]�ACa�������Ȃǃ���������ӌn��j�Q����[44-49]�B������C-�L�i�[�[�̍\�������ł���A���������S�ł����邽�߁A���̌��R���邢�͉ߏ��C-�L�i�[�[�̊�������j�Q����[7,36,50]�j�ɂ��ꍇ�A�܂��R�j���e�j�E���̔@���R�]�ڍ�p�ɂ��ꍇ�A�S�j�L�@�Q���}�j�E���̔@���T�C�g�J�C�����ɃC���^�[�t�F������C���^�[���C�L���iIL�j�|�P�C�Q�̎Y�������ɓ����A�Ɖu�����܁i���邢�͖Ɖu���ߍ܁j�Ƃ��č�p����ꍇ[51]�Ȃǂ�����B
�@���Ȃ݂ɁA���݂܂łɕč������������iNCI�j�ɂ����čR���������e�X�g���ꂽ�����Ȃ�тɃ��^���C�h�������̐���\�S�Ɏ����B�X�Y���ő��i2000��ȏ�j�ŁA���������i��1500��j�ł���B���̑��A�������̂Ƃ��ē��i��1280��j�A�S�i��880��j�A�����i��860��j�A�Z�����i��730��j�Ȃǂ�����[6,49,52]�B
�@���̐i�W�ɑ��Ĕ��ʌ��f���}���I�ɓ����̂́A���݂܂ł̒m���ł́A�����ʂł̈������R�ɂ�鑝�B�}��[42]��A���~�j�E���̑g�D�~�ςɂ�鑝�B�}��[43]�Ȃǂ̑��͂قƂ�ǂ������܂Ƃ��đ̊O��蓊�^���ꂽ�ꍇ�ł���i�\�R�j�B���̐����@���ɂ͂P�j�������̂⓺���̂̔@��DNA�Ƃ̒��ڍ�p�ɂ��ꍇ�A�Q�j�L�@�X�Y�∟���̔@�����B���`�B�n�̑j�Q�i�}�U�A�L�@�X�Y�̓S���W�́A���E�̂ɏW�ς��API��Ӊ�]�ACa�������Ȃǃ���������ӌn��j�Q����[44-49]�B������C-�L�i�[�[�̍\�������ł���A���������S�ł����邽�߁A���̌��R���邢�͉ߏ��C-�L�i�[�[�̊�������j�Q����[7,36,50]�j�ɂ��ꍇ�A�܂��R�j���e�j�E���̔@���R�]�ڍ�p�ɂ��ꍇ�A�S�j�L�@�Q���}�j�E���̔@���T�C�g�J�C�����ɃC���^�[�t�F������C���^�[���C�L���iIL�j�|�P�C�Q�̎Y�������ɓ����A�Ɖu�����܁i���邢�͖Ɖu���ߍ܁j�Ƃ��č�p����ꍇ[51]�Ȃǂ�����B
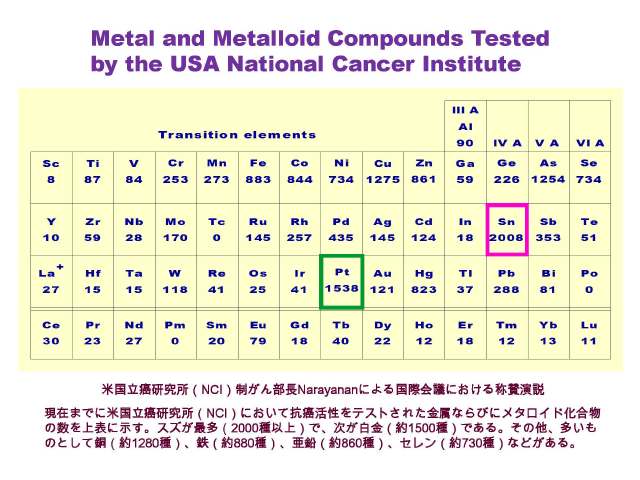
�@���Ȃ݂ɁA���݂܂łɕč������������iNCI�j�ɂ����čR���������e�X�g���ꂽ�����Ȃ�тɃ��^���C�h�������̐���\�S�Ɏ����B�X�Y���ő��i2000��ȏ�j�ŁA���������i��1500��j�ł���B���̑��A�������̂Ƃ��ē��i��1280��j�A�S�i��880��j�A�����i��860��j�A�Z�����i��730��j�Ȃǂ�����[6,49,52]�B

�X�Y�R�����̔����ɑ���č������������i�m�b�h�j�E�������� Narayanan �ɂ��
���ۉ�c�ɂ�����̎^�����i�����̈ꕔ�������j
���ۉ�c�ɂ�����̎^�����i�����̈ꕔ�������j
������
�@���Ɖu�ɂ�������ʌ��f�̂����������܂Ƃ߂Ă݂��B�͂��߂ɏq�ׂ��悤�Ɋ��Ɖu�Ƃ���ɂ��������ʌ��f�̗̈�͔��ɍL�͂ł���A�������̗̈悪�����B����A���̊��Ɖu�@�\�ɂ�������ʌ��f�̖������p�Ɋւ���@����͎͂�ᇖƉu�@�\�S�̂̉𖾂�����Â̏�ő傫���v��������̂Ǝv����B�Ō�ɁA���ʂ̓s���Ŋ����������A�X�̔��ʌ��f�̊e�n�ɂ�����ڍׂȋ@���Ȃǂɂ��Ă͑������Q�Ƃ��ꂽ���B
�@���Ɖu�ɂ�������ʌ��f�̂����������܂Ƃ߂Ă݂��B�͂��߂ɏq�ׂ��悤�Ɋ��Ɖu�Ƃ���ɂ��������ʌ��f�̗̈�͔��ɍL�͂ł���A�������̗̈悪�����B����A���̊��Ɖu�@�\�ɂ�������ʌ��f�̖������p�Ɋւ���@����͎͂�ᇖƉu�@�\�S�̂̉𖾂�����Â̏�ő傫���v��������̂Ǝv����B�Ō�ɁA���ʂ̓s���Ŋ����������A�X�̔��ʌ��f�̊e�n�ɂ�����ڍׂȋ@���Ȃǂɂ��Ă͑������Q�Ƃ��ꂽ���B
���@�@��
1) �r����F���Ɖu�Ɣ��ʌ��f�D ���{��t��G���@�J���[�}���V���[�Y�u�����Ɣ��ʌ��f�v�C�O�ҁi��113���E��8���j�C��ҁi��113���E10���j�A1995
2) �r����F���ʌ��f�̉h�{��Ԃ̕]���Ƃ��Ă̖Ɖu�\�ɂ��āD�u�h�{�\�]���Ǝ��Áv16�F241-251,1999
3) �a�c�@�U�A�r����A�����N���F���ʋ����ƌ��N�D�t�@���}�V�A�D21�F407-413�A1985
4) �a�c�@�U�A�r����A�����@���F���ʌ��f����уr�^�~�����R�ƖƉu�s�S�D�Ɖu�Ǝ����D���ۈ㏑�o�ŁD���W�g�������Ɖu�s�S�nj�Q�h6�F763-767�A1983
5) �r����F�X�Y�ƖƉu�D���ʉh�{�f�����@��11���F13-35�A1994
6) �r����F���̐��������ƖƉu�i�����j�D�Y�Ɖq���w�G�� 39�F1-20, 1997
7) �r����F�Ɖu�ƈ��� Gut Fronts�A���a���ʐM�ANo.4�A7-10�A1995
8) �r����F�Ő������u���@��10���Ɖu�Ő��\�����\�D�n�l���فA�����A1991�D
9) Arakawa Y�FTin and immunity -Review-. Proc. of the 12th World Meeting of the Organotin
Environmental Programme (ORTEP) Association, 35-98,1994
10) Arakawa Y�FTin and immunity -Review-. Biomed Res Trace Elements�@6(2)�F1-34, 1995
11) Hartwell LH, Kastan MB�FCell cycle control and cancer. Science 266�F1821, 1994
12) Askari A, et al. Zinc,copper and parenteral nutrition in cancer. A Review. JPEN 4(6)�F561-571, 1980.
13) Delves HT, et al.�FCopper and zinc concentration in the plasma of leukemic children. Br J Haematol 24�F525-531, 1973.
14) Alexander FW, et al.�FPlasma copper and zinc in acute leukemia. Arch Dis Child 47�F671, 1972.
15) Inutsuka S, et al.�FPlasma copper and zinc levels in patients with malignant tumors of digestive organs. Cancer 42�F626-631, 1978.
16) Strain WM, et al.�FPlasma-Zinc concentration in patients with bronchogenic cancer. Lancet 1�F1021-1022, 1972.
17) Fisher GL, et al.�FCopper and plasma levels in serum from human patients with sarcomas. Cancer 37�F356-363, 1976.
18) Rosoff B, et al.�FTissue distribution of Zinc�U�Tin tumor tissue and normal tissue in man. Nature 207�F652-653, 1965
19) ��؈�K�A��썲�g�q�A�����r��A�p�c���j�F��������ɂ�������ʌ��f�̓��ԂƂ��̗Տ��I�Ӌ`�DBiomed Res Trace Elements 3(2)�F89-90, 1992
20) ��؈�K�A��썲�g�q�A�i���N�Y�A�g�c�r���A�����r��A���D�A�p�c���j�F�̍זE���ɂ����錌���Z�����Z�x�DBiomed Res Trace Elements 1(2)�F131-132, 1990
21) Schrauzer GN, et al�FCancer mortality correlation studies-�V: Statistical associations with dietary selenium intakes. Bioinorg Chem 7�F23-34, 1977.
22) Shamberger RJ, et al.�FAntioxidants and cancer. Part �Y. Selenium and age-adjusted human cancer mortality. Arch. Environ. Health, 31�F231-235, 1976.
23) Willett WC, et al�FPrediagnostic serum selenium and risk of cancer. Lancet 2�F130-134, 1983.
24) Vernie LN�FSelenium in carcinogenesis. Biochim Biophys Acta 738�F203-217, 1984.
25) Clark L, Cantor K and Allaway W�FSelenium in forage crops and cancer mortality in United-States counties. Arch. Environ. Health, 46�F37-42, 1991.
26) Schrauzer GN, Ole Thorlacius-Ussing�FEffects of temporary selenium supplementation on the genesis
of spontaneous mammary tumors in inbred female C�RH/St Mice. Carcinogenesis, 1�F199-201, 1980
27) Ip, C�FProphylaxis of mammary neoplasia by selenium supplementation in the initiation and promotion phases of chemical carcinogenesis. Cancer Res 41�F4386-4390, 1981.
28) Knekt P, et al.�FSerum vitamin E, serum selenium and the risk of gastrointestinal cancer. Int J Cancer 42�F846-850, 1988.
29) Kobayashi M, et al.�FInhibitory effect of dietary selenium on carcinogenesis in rat glandular stomach induced by n-methyl-n'-nitro-n-nitrosoguanidine. Cancer Res 46�F2266-2270, 1986.
30) Jacobs MM, et al.�FBiochemical and clinical effects of selenium on dimethylhydrazine-induced colon cancer in rats. Cancer Res., 41�F4458-4465, 1981.
31) Thompson HJ, et al.�FSelenium inhibition of n-methyl-n-nitrosourea-induced mammary carcinogenesis
in the rat. J Natl Cancer Res 65�F1299-1301, 1980.
32) LeBoeuf, RA, et al.�FEffects of dietary selenium concentration on the development of enzyme-altered liver foci and hepatocellular carcinoma induced by diethylnitrosamine or n-acetylaminofluorene in rats. Cancer Res 45�F5489-5495, 1985.
33) Ip C, et al.�FChemical form of selenium, critical metabolites, and cancer prevention. Cancer Res 51�F595-600, 1991.
34) De Wys W, et al.�FInhibition of a spectrum of animal tumors by dietary zinc deficiency. J Natl Cancer Inst 48�F375-381, 1972.
35) Mills BJ et al.�FA specific dietary zinc reguirement for the growth of Walker 256/Ml tumor in the rat. Am J Clin Nutr 34�F1661-1669, 1981.
36) McQuitty JT, et al.�FInhibition of tumor growth by dietary zinc deficiency. Cancer Res 30�F1387-1390, 1970.
37) Schulmacher J, et al.�FIn vivo uptake of Co�T�V, Mn�T�S, and Zn�U�T by peripheral lymphocytes, tumor and
various organs of rats bearing walker 256 carcinosarcoma. Eur J Cancer 15�F1365-1370, 1979.
38) Minkel DT, et al.�FZinc deficiency and growth of ehrlich ascites tumor. Cancer Res 39�F2451-2456,1979.
39) Saito T, et al.�FSerum Zn content in tumor-bearing rats treated with anticancer drugs. Tohoku J Exp Med 129�F111-121, 1979.
40) �L�c���F�A������A�X�e���i�A���m���A���������A�L���M���F��ᇑ��B�ɂ����鈟���̈Ӌ`�ɂ��āDBiomed Res Trace Elements 2�F109-110, 1991.
41) Phillips JC, et al.: Effect of zinc administration on growth of L1210 and BW 5147 tumors in mice. J Natl Cancer Inst 57�F361-363, 1976.
42) McQuitty JT, et al�FInhibition of tumor growth by dietary zinc deficiency. Cancer Res 30�F1387-1390, 1970
43) �R�����O�F���w�����ɑ���Al�̗}�����ʁD���ʋ������6�A1-6�A1978
44) Arakawa Y, Wada O�FChapter 9, Suppression of cell Proliferation by certain organotin compounds. in Tin
and Malignant Cell Growth. (Zuckerman, J.J., ed.), CRC Press, Florida, U.S.A., pp 83-106, 1988
45) Arakawa Y�FChapter 23, Antitumor activity of organotin compounds and Inhibition of membrane signal
transduction. in Chemistry and Technology of Silicon and Tin.(Kumar Das V.G., Gielen, M., ed.), Oxford University Press, Oxford, U.K., pp 319-333, 1992
46) Arakawa Y and Wada O�FChapter 4, Biological properties of alkyltin compounds. In Metal Ions in Biological Systems, Volume 29, Biological Properties of Metal Alkyl Derivatives. (Sigel, H., ed.), Marcel Dekker, Inc., New York, U.S.A., pp 101-136, 1993
47) Arakawa Y�FAntitumour activity of organotin compounds and membrane-mediated inhibition of signal transduction leading to DNA synthesis. Main Group Metal Chemistry, 17, 225-249, 1994
48) Arakawa Y�FCellular and biochemical aspects of antitumor activity of organotin compounds. in Main Group Elements and Their Compounds (V.G.Kumar Das ed.). Narosa Publishing House, New Delhi, India, 422-445, 1996
49) Arakawa Y�FChapter 10 Recent studies on the mode of biological action of the di- and tri-alkyltin compounds. in Chemistry of Tin (P.J. Smith ed.). Blackie Academic & Professional, Chapman & Hall, Glasgow, U.K. , 388-428, 1999
50) Andrew FG et al�FThe regulatory domein of protein kinase C cordinates gour atoms of zinc. J Biol Chem
267�F10193-10197, 1992
51) DiMartino MJ, Lee JC, Badger AM, Muirhead KA, Mirabelli CK, Hanna N�FAntiarthritic and
immunoregulatory activity of spirogermanium. J Pharmacol Exp Ther 236�F103-110, 1986
52) Narayanan VL, Nasv M, Paull KD�FTin-Based Antitumor Drugs. (ed) by Marcel Gielen, Springer-Verlag, Berlin Heidelberg NATO ASI Series, pp.201-217, 1990
1) �r����F���Ɖu�Ɣ��ʌ��f�D ���{��t��G���@�J���[�}���V���[�Y�u�����Ɣ��ʌ��f�v�C�O�ҁi��113���E��8���j�C��ҁi��113���E10���j�A1995
2) �r����F���ʌ��f�̉h�{��Ԃ̕]���Ƃ��Ă̖Ɖu�\�ɂ��āD�u�h�{�\�]���Ǝ��Áv16�F241-251,1999
3) �a�c�@�U�A�r����A�����N���F���ʋ����ƌ��N�D�t�@���}�V�A�D21�F407-413�A1985
4) �a�c�@�U�A�r����A�����@���F���ʌ��f����уr�^�~�����R�ƖƉu�s�S�D�Ɖu�Ǝ����D���ۈ㏑�o�ŁD���W�g�������Ɖu�s�S�nj�Q�h6�F763-767�A1983
5) �r����F�X�Y�ƖƉu�D���ʉh�{�f�����@��11���F13-35�A1994
6) �r����F���̐��������ƖƉu�i�����j�D�Y�Ɖq���w�G�� 39�F1-20, 1997
7) �r����F�Ɖu�ƈ��� Gut Fronts�A���a���ʐM�ANo.4�A7-10�A1995
8) �r����F�Ő������u���@��10���Ɖu�Ő��\�����\�D�n�l���فA�����A1991�D
9) Arakawa Y�FTin and immunity -Review-. Proc. of the 12th World Meeting of the Organotin
Environmental Programme (ORTEP) Association, 35-98,1994
10) Arakawa Y�FTin and immunity -Review-. Biomed Res Trace Elements�@6(2)�F1-34, 1995
11) Hartwell LH, Kastan MB�FCell cycle control and cancer. Science 266�F1821, 1994
12) Askari A, et al. Zinc,copper and parenteral nutrition in cancer. A Review. JPEN 4(6)�F561-571, 1980.
13) Delves HT, et al.�FCopper and zinc concentration in the plasma of leukemic children. Br J Haematol 24�F525-531, 1973.
14) Alexander FW, et al.�FPlasma copper and zinc in acute leukemia. Arch Dis Child 47�F671, 1972.
15) Inutsuka S, et al.�FPlasma copper and zinc levels in patients with malignant tumors of digestive organs. Cancer 42�F626-631, 1978.
16) Strain WM, et al.�FPlasma-Zinc concentration in patients with bronchogenic cancer. Lancet 1�F1021-1022, 1972.
17) Fisher GL, et al.�FCopper and plasma levels in serum from human patients with sarcomas. Cancer 37�F356-363, 1976.
18) Rosoff B, et al.�FTissue distribution of Zinc�U�Tin tumor tissue and normal tissue in man. Nature 207�F652-653, 1965
19) ��؈�K�A��썲�g�q�A�����r��A�p�c���j�F��������ɂ�������ʌ��f�̓��ԂƂ��̗Տ��I�Ӌ`�DBiomed Res Trace Elements 3(2)�F89-90, 1992
20) ��؈�K�A��썲�g�q�A�i���N�Y�A�g�c�r���A�����r��A���D�A�p�c���j�F�̍זE���ɂ����錌���Z�����Z�x�DBiomed Res Trace Elements 1(2)�F131-132, 1990
21) Schrauzer GN, et al�FCancer mortality correlation studies-�V: Statistical associations with dietary selenium intakes. Bioinorg Chem 7�F23-34, 1977.
22) Shamberger RJ, et al.�FAntioxidants and cancer. Part �Y. Selenium and age-adjusted human cancer mortality. Arch. Environ. Health, 31�F231-235, 1976.
23) Willett WC, et al�FPrediagnostic serum selenium and risk of cancer. Lancet 2�F130-134, 1983.
24) Vernie LN�FSelenium in carcinogenesis. Biochim Biophys Acta 738�F203-217, 1984.
25) Clark L, Cantor K and Allaway W�FSelenium in forage crops and cancer mortality in United-States counties. Arch. Environ. Health, 46�F37-42, 1991.
26) Schrauzer GN, Ole Thorlacius-Ussing�FEffects of temporary selenium supplementation on the genesis
of spontaneous mammary tumors in inbred female C�RH/St Mice. Carcinogenesis, 1�F199-201, 1980
27) Ip, C�FProphylaxis of mammary neoplasia by selenium supplementation in the initiation and promotion phases of chemical carcinogenesis. Cancer Res 41�F4386-4390, 1981.
28) Knekt P, et al.�FSerum vitamin E, serum selenium and the risk of gastrointestinal cancer. Int J Cancer 42�F846-850, 1988.
29) Kobayashi M, et al.�FInhibitory effect of dietary selenium on carcinogenesis in rat glandular stomach induced by n-methyl-n'-nitro-n-nitrosoguanidine. Cancer Res 46�F2266-2270, 1986.
30) Jacobs MM, et al.�FBiochemical and clinical effects of selenium on dimethylhydrazine-induced colon cancer in rats. Cancer Res., 41�F4458-4465, 1981.
31) Thompson HJ, et al.�FSelenium inhibition of n-methyl-n-nitrosourea-induced mammary carcinogenesis
in the rat. J Natl Cancer Res 65�F1299-1301, 1980.
32) LeBoeuf, RA, et al.�FEffects of dietary selenium concentration on the development of enzyme-altered liver foci and hepatocellular carcinoma induced by diethylnitrosamine or n-acetylaminofluorene in rats. Cancer Res 45�F5489-5495, 1985.
33) Ip C, et al.�FChemical form of selenium, critical metabolites, and cancer prevention. Cancer Res 51�F595-600, 1991.
34) De Wys W, et al.�FInhibition of a spectrum of animal tumors by dietary zinc deficiency. J Natl Cancer Inst 48�F375-381, 1972.
35) Mills BJ et al.�FA specific dietary zinc reguirement for the growth of Walker 256/Ml tumor in the rat. Am J Clin Nutr 34�F1661-1669, 1981.
36) McQuitty JT, et al.�FInhibition of tumor growth by dietary zinc deficiency. Cancer Res 30�F1387-1390, 1970.
37) Schulmacher J, et al.�FIn vivo uptake of Co�T�V, Mn�T�S, and Zn�U�T by peripheral lymphocytes, tumor and
various organs of rats bearing walker 256 carcinosarcoma. Eur J Cancer 15�F1365-1370, 1979.
38) Minkel DT, et al.�FZinc deficiency and growth of ehrlich ascites tumor. Cancer Res 39�F2451-2456,1979.
39) Saito T, et al.�FSerum Zn content in tumor-bearing rats treated with anticancer drugs. Tohoku J Exp Med 129�F111-121, 1979.
40) �L�c���F�A������A�X�e���i�A���m���A���������A�L���M���F��ᇑ��B�ɂ����鈟���̈Ӌ`�ɂ��āDBiomed Res Trace Elements 2�F109-110, 1991.
41) Phillips JC, et al.: Effect of zinc administration on growth of L1210 and BW 5147 tumors in mice. J Natl Cancer Inst 57�F361-363, 1976.
42) McQuitty JT, et al�FInhibition of tumor growth by dietary zinc deficiency. Cancer Res 30�F1387-1390, 1970
43) �R�����O�F���w�����ɑ���Al�̗}�����ʁD���ʋ������6�A1-6�A1978
44) Arakawa Y, Wada O�FChapter 9, Suppression of cell Proliferation by certain organotin compounds. in Tin
and Malignant Cell Growth. (Zuckerman, J.J., ed.), CRC Press, Florida, U.S.A., pp 83-106, 1988
45) Arakawa Y�FChapter 23, Antitumor activity of organotin compounds and Inhibition of membrane signal
transduction. in Chemistry and Technology of Silicon and Tin.(Kumar Das V.G., Gielen, M., ed.), Oxford University Press, Oxford, U.K., pp 319-333, 1992
46) Arakawa Y and Wada O�FChapter 4, Biological properties of alkyltin compounds. In Metal Ions in Biological Systems, Volume 29, Biological Properties of Metal Alkyl Derivatives. (Sigel, H., ed.), Marcel Dekker, Inc., New York, U.S.A., pp 101-136, 1993
47) Arakawa Y�FAntitumour activity of organotin compounds and membrane-mediated inhibition of signal transduction leading to DNA synthesis. Main Group Metal Chemistry, 17, 225-249, 1994
48) Arakawa Y�FCellular and biochemical aspects of antitumor activity of organotin compounds. in Main Group Elements and Their Compounds (V.G.Kumar Das ed.). Narosa Publishing House, New Delhi, India, 422-445, 1996
49) Arakawa Y�FChapter 10 Recent studies on the mode of biological action of the di- and tri-alkyltin compounds. in Chemistry of Tin (P.J. Smith ed.). Blackie Academic & Professional, Chapman & Hall, Glasgow, U.K. , 388-428, 1999
50) Andrew FG et al�FThe regulatory domein of protein kinase C cordinates gour atoms of zinc. J Biol Chem
267�F10193-10197, 1992
51) DiMartino MJ, Lee JC, Badger AM, Muirhead KA, Mirabelli CK, Hanna N�FAntiarthritic and
immunoregulatory activity of spirogermanium. J Pharmacol Exp Ther 236�F103-110, 1986
52) Narayanan VL, Nasv M, Paull KD�FTin-Based Antitumor Drugs. (ed) by Marcel Gielen, Springer-Verlag, Berlin Heidelberg NATO ASI Series, pp.201-217, 1990








![�]�_�o�@�\�Ɣ��ʌ��f �]�_�o�@�\�Ɣ��ʌ��f](dataimge/1499133990_1.jpg)









